Produkt kosmetyczny oznacza każdą substancję lub mieszaninę przeznaczoną do kontaktu z zewnętrznymi częściami ciała ludzkiego (naskórkiem, owłosieniem, paznokciami, wargami oraz zewnętrznymi narządami płciowymi) lub z zębami oraz błonami śluzowymi jamy ustnej, którego wyłącznym lub głównym celem jest utrzymywanie ich w czystości, perfumowanie, zmiana ich wyglądu, ochrona, utrzymywanie w dobrej kondycji lub korygowanie zapachu ciała [1].
W 2022 r. mieszkaniec Europy wydał z budżetu domowego na kosmetyki średnio 126 euro. Badania ankietowe wykazały, że 72 proc. europejskich konsumentów uważa kosmetyki za ważne lub bardzo ważne w codziennym życiu i używa średnio 7 kosmetyków na co dzień oraz 13 tygodniowo. 70 proc. Europejczyków deklaruje, że stosuje produkty kosmetyczne, aby dodać sobie pewności siebie.
Czy kosmetyki mogą być groźne dla zdrowia?
Powszechność stosowania kosmetyków sprawia, że obecność w nich drobnoustrojów stwarza realne zagrożenia dla zdrowia publicznego. Kosmetyki coraz częściej postrzegane są, jako potencjalne źródło groźnych patogenów człowieka i bakterii wielolekoopornych – metycylinoopornych gronkowców złocistych (MRSA), enterokoków opornych na wysokie stężenia antybiotyków aminoglikozydowych (HLAR), opornych na glikopeptydy (VRE) i linezolid (LRE) i gramujemnych pałeczek wytwarzających β-laktamaz różnych klas [3,4].
Producent wyrobu kosmetycznego musi zagwarantować bezpieczeństwo produktu w zwykłych oraz możliwych do przewidzenia warunkach użytkowania. Bezpieczeństwo mikrobiologiczne jest jednym z najważniejszych aspektów kontroli przemysłu kosmetycznego. Podstawowym zagrożeniem wynikającym z obecności drobnoustrojów w kosmetyku jest możliwość zakażenia osoby użytkującej. Są to najczęściej infekcje skóry i błoń śluzowych. Obowiązujące w przemyśle kosmetycznym normy PN-EN powodują, że zakażenia od kosmetyków nie są zjawiskiem częstym, ale mogą mieć nawet charakter zakażeń szpitalnych o ciężkim przebiegu. Drobnoustroje z kosmetyku mogą przedostać się do organizmu ludzi przez uszkodzoną skórę lub błony śluzowe.
Źródła zanieczyszczenia kosmetyków
Większość kosmetyków z powodu zawartości dużej ilości wody, związków organicznych i nieorganicznych mogących być „pokarmem” dla drobnoustrojów, stanowi świetną pożywkę dla wzrostu bakterii i grzybów. Zanieczyszczenie kosmetyku drobnoustrojami może mieć charakter skażenia pierwotnego bądź wtórnego.
Pierwotne skażenie kosmetyku w dużej mierze zależy od czystości mikrobiologicznej surowców. Szczególne zagrożenie obecnością chorobotwórczych drobnoustrojów stwarzają surowce pochodzenia naturalnego, które w procesie ich otrzymywanie nie były poddawane wysokiej temperaturze. Źródłem drobnoustrojów może być także woda. Ważnym źródłem skażenia mikrobiologicznego kosmetyków jest także personel biorący udział w produkcji, ale również brak przestrzegania odpowiedniej czystości środowiska wytwarzania kosmetyków. Dlatego w czasie produkcji niezbędne jest postępowanie zgodnie z wytycznymi zawartymi w Dobrej Praktyce Wytwarzania (GMP), odpowiednie zabezpieczenie wyrobu przed namnażaniem się drobnoustrojów, a także stałe monitorowanie czystości mikrobiologicznej i restrykcyjne przestrzeganie norm obowiązujących w przemyśle kosmetycznym [5,6,7].Wtórna dekontaminacja produktu powstaje w wyniku nieprawidłowego przechowywania czy użytkowania kosmetyku. Może ją wywołać wiele czynników, takich jak podwyższona temperatura, dostęp powietrza, zwiększona wilgotność i promieniowanie słoneczne.
Do czynników biologicznych, które najczęściej przyczyniają się do wtórnej kontaminacji kosmetyków, w trakcie ich użytkowania, zaliczyć można drobnoustroje stanowiące mikrobom skóry człowieka (użytkowników kosmetyków). Liczba drobnoustrojów na 1 cm2 skóry człowieka mieści się w granicach od 102 do 106 CFU, choć skład ilościowy i gatunkowy zależny jest od rozmieszczenia gruczołów potowych i łojowych na skórze. Prawidłowy mikrobiom skóry człowieka tworzą głównie gatunki bakterii z 4 typów: Actinobacteria, Proteobacteria, Firmicutes i Bacteroides. [8,9,10,11]. Drobnoustroje takie jak: Staphylococcus aureus, Enterococcus spp., Escherichia coli, Klebsiella spp., Enterobacter spp., Serratia spp., Acinetobacter spp., Salmonella spp., Shigella spp. czy Candida albicans mogą być przejściowym elementem mikrobiomu skóry dłoni ludzi. Stwarza to możliwość wprowadzenia ich do produktu kosmetycznego w trakcie jego użytkowania [12]. Gdy produkt jest używany, konsumenci mają obowiązek dbać o jego bezpieczeństwo, np. poprzez przestrzeganie instrukcji bezpiecznego przechowywania produktu i metod aplikacji kosmetyku na skórę.
W celu ograniczenia rozwoju drobnoustrojów w produkcie kosmetycznym o wysokim ryzyku kontaminacji w trakcie jego użytkowania, stosuje się w nim odpowiednie układy konserwujące.
Drobnoustroje takie jak Pseudomonas aeruginosa, Staphylococcus aureus, Escherichia coli i Candida albicans to istotne patogeny człowieka, które równocześnie mogą stanowić zanieczyszczenie mikrobiologiczne kosmetyków. Ich obecność wg obowiązującego prawa jest niedozwolona i ich brak w produkcie kosmetycznym musi być potwierdzona badaniami. Gatunki te w mikrobiologii kosmetyków określane są, jako drobnoustroje specyficzne [13].
Pierwotne jak i wtórne skażenie kosmetyków może być powodowane również niespecyficznymi gatunkami bakterii gramdodatnich i gramujemnych, których monitorowanie w produkcie kosmetycznym nie jest wymagane.
Do bakterii gramdodatnich najczęściej izolowanych z kosmetyków należą bakterie tlenowe i względnie beztlenowe z rodzajów: Staphylococcus (gatunki koagulazoujemne), Micrococcus, Enterococcus, Bacillus czy Glutamicibacter. Znajdujemy wśród nich gatunki będące drobnoustrojami oportunistycznymi i bezwzględnymi patogenami [14,15].
Z bakterii gramujemnych najczęściej z kosmetyków izolowano: bakterie z rodziny Burkholderiaceae, Pseudomonadaceae, Moraxellaceae, Flavobacteriaceae (wszystkie one nie fermentują glukozy) oraz fermentujące glukozę bakterie z rodziny Enterobacteriacea, Yersiniacea, Morganellaceae. Są wśród nich gatunki oportunistyczne i typowe patogeny [14, 15].
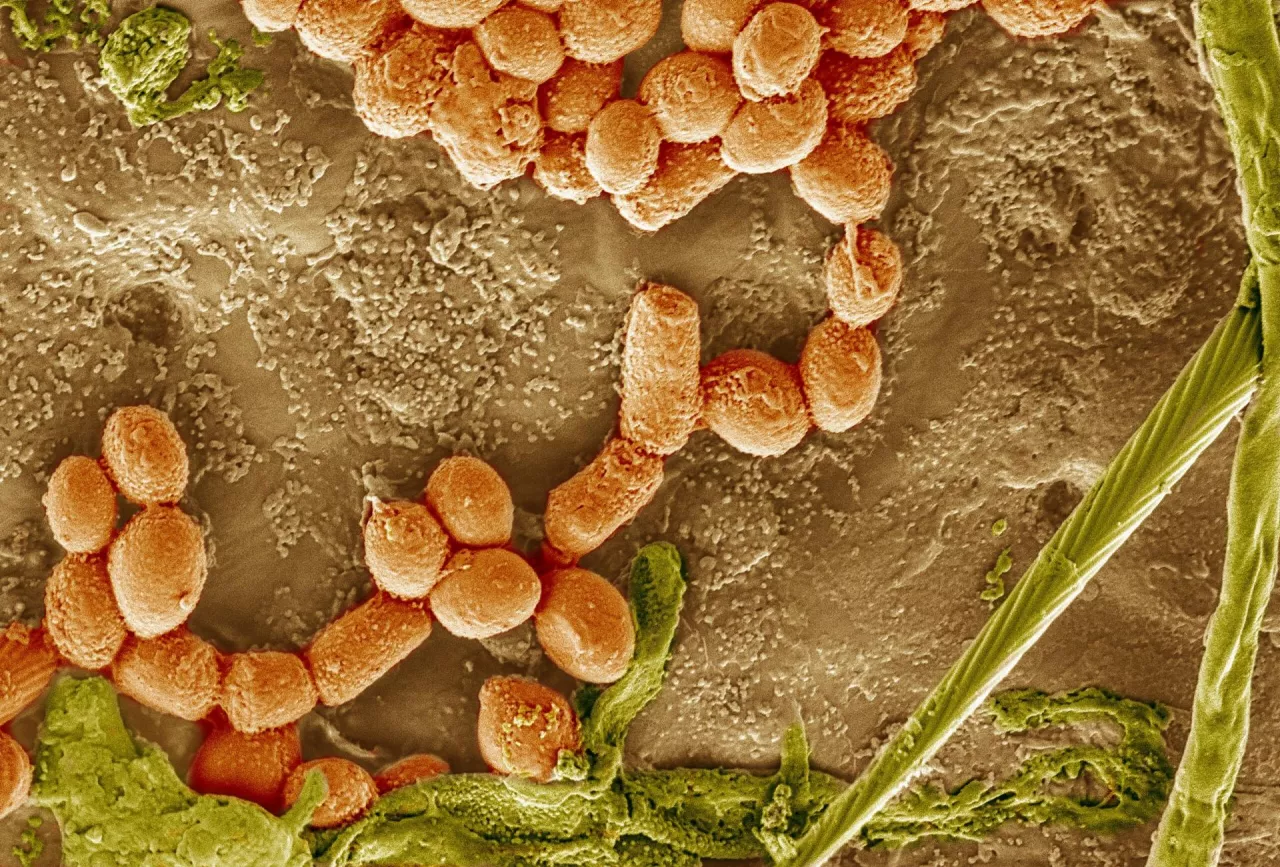
Pluralibacter gergoviae - patogen, który martwi biologów
Z naszych doświadczeń, jaki i z danych literaturowych wynika, że coraz istotniejszym zagrożeniem mikrobiologicznym w kosmetykach staje się Pluralibacter gergoviae (dawniej Enterobacter gergoviae). Gatunek ten tworzą trudny do usunięcia biofilm, charakteryzuje się małymi wymaganiami pokarmowymi, opornością na środki dezynfekcyjne, w tym konserwanty i antybiotyki [16,17,18,19].
Pluralibacter gergoviae, to typowy patogen oportunistyczny. Po raz pierwszy został opisany przez Richarda w 1976 r., który wyizolował go z próbek moczu pobranych od pacjentów Szpitala Uniwersyteckiego w Clermont-Ferrand niedaleko Gergoviae Highland we Francji. Izolowano go także z wody, gleby i ścieków, jak i kosmetyków, ziaren kawy, czy produktów mleczarskich. W niewielkich ilościach może być elementem mikrobiomu przewodu pokarmowego ludzi i zwierząt. Zakażenia u ludzi powodowane tym drobnoustrojem są dość rzadkie, w związku z tym nie ma wielu danych literaturowych opisujących te infekcje. Odpowiedzialny jest on przede wszystkim za infekcje układu moczowego, krwi i układu oddechowego. Odnotowano także kilka przypadków zapalenia gałki ocznej, kości i szpiku oraz zapalenia otrzewnej [20,21,22,23].
Coraz mocniej podkreśla się, że gatunek ten stanowi istotne mikrobiologiczne zagrożenie w kosmetykach. Zaczęto go wykrywać w wielu produktach kosmetycznych takich jak: żele złuszczające, eyelinery, podkłady, szampony, żele pod prysznic, masło shea, odżywki do włosów, płyny do kąpieli i chusteczki dla niemowląt [24,25,26].
Pluralibacter gergoviae - co to takiego?
Pluralibacter gergoviae to gramujemna pałeczka z rodziny Enterobacteriacea. Fermentuje glukozę, redukuje azotany i nie wytwarza oksydazy cytochromowej. Wytwarza ureazę, wykorzystuje cytrynian jako jedyne źródło węgla, dekarboksyluje lizynę, nie wytwarza indolu i siarkowodoru. Fermentuje laktozę z opóźnieniem, co powoduje, że na podłożu McConkeya po 24 godzinnej inkubacji tworzy blado-różowe kolonie, a różowe dopiero po 48-72 godzinnej hodowli. Wyrasta na podłożu z cetrimidem dedykowanym wykrywaniu P. aeruginosa. Niektóre szczepy mogą charakteryzować się opornością na chloramfenikol co umożliwia wzrost bakterii na podłożu Sabouraud Dextrose Agar zawierającym ten antybiotyk. Podłoże to rutynowo w mikrobiologii kosmetyków wykorzystywane jest do wykrawania grzybów pleśniowych i drożdżopodobnych. Identyfikacja drobnoustroju z wykorzystaniem podstawowych metod diagnostyki mikrobiologicznej może być trudna. Prawidłowej identyfikacji można dokonać z wykorzystaniem numerycznych zestawów testów biochemicznych, techniki MALDI-TOF MS czy coraz szerzej wykorzystywanych w mikrobiologii kosmetyków technik biologii molekularnej (PCR, Real-Time PCR).
Oporność na parabeny, antybiotyki i chemioterapeutyki
Cechą szczepów P. gergoviae jest oporność na parabeny, które są szeroko stosowane, jako konserwanty w przemyśle kosmetycznym, farmaceutycznym i spożywczym. Mechanizm przeciwdrobnoustrojowego działania parabenów jest wielokierunkowy i nie został do końca wyjaśniony. Podejrzewa się, że są one inhibitorami syntezy kwasów nukleinowych DNA i RNA lub też hamują działanie enzymów niezbędnych do prawidłowego funkcjonowania komórek bakteryjnych, takich jak ATP i fosfotransferazy. Parabeny mogą działać także poprzez zakłócanie procesów transportu błonowego. Ponadto mogą hamować
transport aminokwasów, takich jak alanina, seryna, fenyloalanina przez błonę cytoplazmatyczną komórek bakteryjnych, nie zmieniając przy tym transportu glukozy. Prawdopodobne jest również działanie polegające na denaturacji białek bakteryjnych, nasilające się w środowisku kwasowym [27,28,29,30,31,32,33]. Oporność P.gergoviae na parabeny związana jest przed wszystkim obecnością genów kodujących białka pomp efflux (MDR) aktywnie je usuwających z komórki. Umożliwia to przeżywanie bakterii w produkcie kosmetycznym a nawet wzrost. Obecność drobnoustroju w kosmetyku w ilości zgodnej z normami obowiązującymi w przemyśle kosmetycznym może także wpływać na nieprawidłowy odczyt testu konserwacji.Szczególne zagrożenie dla zdrowia publicznego stanowią obecne w kosmetykach szczepy P. gergoviae niosące geny oporności na antybiotyki i chemioterapetyki. Niektóre szczepy P. gergoviae izolowane z kosmetyków w naszym laboratorium charakteryzowały się nie tylko opornością na parabeny, ale wytwarzały także beta-laktamazy o rozszerzonym spektrum substratowym (ESβL). ESβL to enzymy zdolne do hydrolizy wszystkich penicylin, cefalosporyn (oprócz cefamycyn) i monobaktamów. Wytwarzane są przede wszystkim przez szpitalne szczepy pałeczek różnych gatunków z rodziny Enterobacteriaceae, ale także coraz częściej przez szczepy poza szpitalne. Enzymy ESβL zaliczane są do nabytych i kodowanych plazmidowo β-laktamaz. Geny kodujące ESβL zlokalizowane są najczęściej na plazmidach koniugacyjnych, co sprzyja ich szybkiemu rozprzestrzenianiu się, również pomiędzy szczepami filogenetycznie odległymi [34].
Ostrzeżenie od FDA dla producentów kosmetyków
Mimo iż, kontrola obecności P. gergoviae w kosmetykach nie jest obowiązkowa i nie należy do szeregu podstawowych badań kontroli jakości, coraz więcej firm produkujących kosmetyki włącza izolaty środowiskowe, takie jak P. gergoviae do rutynowych procesów kontroli jakości produkcji. Mimo wdrożonych procedur, wynikających z Dobrej Praktyki Produkcyjnej i norm ISO, w ciągu ostatnich pięciu lat, dzięki zgłoszeniom w systemie RAPEX, wycofano produkty kosmetyczne, w których wykryto P. gergoviae [35,36].
W 2016 roku, FDA (Food and Drug Administration) wystosowała pismo ostrzegawcze do producentów kosmetyków, w których wykryto ten drobnoustrój. Agencja podkreśliła, że mimo to, że kontrola obecności tej bakterii w gotowym produkcie kosmetycznym nie jest obowiązkowa, to stwarza ona realne zagrożenie dla zdrowia konsumentów. Dotyczy to szczególnie osób o obniżonej odporności, u których infekcje powodowane przez P. gergoviae mogą charakteryzować się ciężkim przebiegiem. FDA skrytykowała również producentów za nieprzeprowadzenie należytej kontroli i weryfikacji jakości surowców jak i gotowego produktu oraz nie zachowała odpowiedniej czystości zakładu przemysłowego i wykorzystywanego do produkcji sprzętu [37].
Występowanie drobnoustrojów chorobotwórczych w produktach kosmetycznych stanowi problem dla zdrowia publicznego. Do takich patogenów oportunistycznych z pewnością należy P. gergoviae, który może być szczególnie niebezpieczny dla osób z obniżoną odpornością. Jego obecność w produkcie kosmetycznym, może zostać przeoczona, ponieważ normy PN-EN obowiązujące w przemyśle kosmetycznym nie wskazują metod jego wykrywania. Ogromne znaczenie ma więc niezwykła dbałość o czystość mikrobiologiczną surowców, szczególnie tych pochodzenia naturalnego i monitoring środowiska produkcji.
Piśmiennictwo
(uporządkowane wg kolejności cytowania)
1. Rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 1223/2009 z dnia 30 listopada 2009 r. dotyczące produktów kosmetycznych. https://eur-lex.europa.eu/legal-content/PL/TXT/HTML/?uri=CELEX:32009R1223&from=EN [dostęp na dn. 27.09.2023 r.]
2. https://cosmeticseurope.eu/cosmetic-products/european-consumer-perception-study-2022/
3. Nusrat N, Ahmad Zahra M, Ahmed A, Haque F. Assessment of potential pathogenic bacterial load and multidrug resistance in locally manufactured cosmetics commonly used in Dhaka metropolis. Sci Rep. 2023, 13(1), 7787.
4. Orús P, Gomez-Perez L, Leranoz S, Berlanga M. Increasing antibiotic resistance in preservative-tolerant bacterial strains isolated from cosmetic products. Int Microbiol. 2015, 18(1), 51-59.
5. Sumit A.F, Sharmin T, Ahmed T, Evaluation of the in vitro Antimicrobial Activity As well As Preservative Capacity of Several Popular Cosmetic Products Available in the Neighbouring Shops in Bangladesh. Mymensingh Med J. 2021, 30 (2), 478-484.
6. Jairoun A.A, Al-Hemyari S.S, Shahwan M. An Investigation into Incidences of Microbial Contamination in Cosmeceuticals in the UAE: Imbalances between Preservation and Microbial Contamination”. Cosmetics. 2020, 7(4), 1-14.
7. Dao H, Lakhani P, Police A, Kallakunta V, Ajjarapu SS, Wu KW, Ponkshe P, Repka MA, Narasimha Murthy S. Microbial Stability of Pharmaceutical and Cosmetic Products. AAPS Pharm Sci Tech. 2018, 19(1):60-78.
8. Byrd, A. L, Belkaid Y, Segre J. A..The Human Skin Microbiome. Nat. Rev. Microbiol. 2018, 16 (3), 143–155.
9. Carvalho M.J, S Oliveira A.L, Santos Pedrosa S, Pintado M, Pinto-Ribeiro I, Madureira AR. Skin Microbiota and the Cosmetic Industry. Microb Ecol. 2023, 86(1), 86-96.
10. Cundell AM. Microbial Ecology of the Human Skin. Microb Ecol. 2018, 76(1):113-120.
11. Campana R, Scesa C, Patrone V, Vittoria E, Baffone W. Microbiological study of cosmetic products during their use by consumers: health risk and efficacy of preservative systems. Lett Appl Microbiol. 2006, 43(3):301-6.
12. Achinike Okwelle A, Okwuchi Olorunbe P, Pathogenic bacteria colonization of the skin of some students of Ignatius Ajuru University of Education, Rumuolumeni, Port Harcout, GSC Biological and Pharmaceutical Sciences. 2022, 21(1), 223–228.
13. Norma PN-EN ISO 17516:2014-11. Kosmetyki -Mikrobiologia -Limity mikrobiologiczne.
14. Ouaghrem M.B, Vaugelade S, Bourcier S, Genty C, Pirnay S, Bouchonnet S, Characterization of photoproducts and global ecotoxicity of chlorphenesin: A preservative used in skin care products, International Journal of Cosmetic Science. 2022, 1, 10-19.
15. Bashir A, Lambert P, Microbiological study of used cosmetic products: highlighting possible impact on consumer health, Journal of Applied Microbiology. 2020, 128(2), 598–605.
16. Périamé M, Philippe N, Condell O, Fanning S, Pagès JM, Davin-Regli A. Phenotypic changes contributing to Enterobacter gergoviae biocide resistance. Lett Appl Microbiol. 2015, 61(2):121-9.
17. Périamé M, Pagès JM, Davin-Regli A. Enterobacter gergoviae membrane modifications are involved in the adaptive response to preservatives used in cosmetic industry. J Appl Microbiol. 2015,118(1), 49-61.
18. Périamé M, Pagès JM, Davin-Regli A. Enterobacter gergoviae adaptation to preservatives commonly used in cosmetic industry. Int J Cosmet Sci. 2014, 36(4), 386-95.
19. Coate E, Merchen T, Cybulski R, Collier R, Mc Gann P, Mills E, Novel discovery of Extended Spectrum β-lactamase (ESBL) Pluralibacter gergoviae in acute urinary tract infection and urolithiasis, American Journal of Clinical Pathology. 2021, 156, S128.
20. Ganeswire R., Thong K., Puthucheary S., Nosocomial out break of Enterobacter gergoviae bacteraemia in a neonatal intensive care unit. J. Hosp Infect, 2003, 53 (4), 292-296.
21. Freire M, de Oliveira Garcia D., Cury A. i in. Outbreak of IMP-producing carbapenem-resistant Enterobacter gergoviae among kidney transplant recipiens. J Antimicrob Chemother, 2016, 71 (9), 2577-2585.
22. Ganeswire R, Thong K, Puthucheary S, Nosocomial outbreak of Enterobacter gergoviae bacteraemia in a neonatal intensive care unit, J. Hosp Infect, 2003, 53 (4), 292-296.
23. Misya‘il Abdul Rashid A., Thiam Seong Lim Ch. Enterobacter gergoviae peritonitis in a patient on chronic ambulatory peritoneal dialysis - first reported case, Malaysian Journal of Medicine and Health Sciences. 2017, 13 (2), 67-69.
24. Neza E, Centini M, Microbiologically Contaminated and Over-Preserved Cosmetic Products According Rapex 2008–2014. MDPI, Cosmetics, 2016, 3 (3), 1-11.
25. Périamé M, Pagés J.M, Davin-Regli A. Enterobacter gergoviae adaptation to preservatives commonly used in cosmetics industry. International Journal of Cosmetic Science, 2014, 36 (4), 386-395.
26. Sutton, S., Jimenez, L. A review of reported recalls involving microbiological control 2004-2011 with emphasis on FDA considerations of „objectionable organisms” American Pharmaceutical Review. 2012, 15, 42-57.
27. Bojarowicz H, Wojciechowska M and Gocki J. Substancje konserwujące stosowane w kosmetykach oraz ich działania niepożądane. Problemy Higieny i Epidemiologii, 2008, 89, 30-33.
28. Bojarowicz H, Wnuk M, Buciński A. Efektywność i bezpieczeństwo stosowania parabenów, Problemy Higieny i Epidemiologii. 2012, 93, 647-653.
29. Pons–Guiraud A, Lafforgue C. Parabens: what to tell our patients, 2012 www.dermocosmetologie.fr [dostęp na dzień 27.09.2023 r.]
30. Roden K. Preservatives in personal care products. Microbiology Australia. 2010, 9, 195-197.
31. Siegert W. Microbiological quality management for the production of cosmetics and toiletries. Cosmetic Science Technologies. 2005, 89-195.
32. A. Davin-Regli, R. Chollet, J. Bredin, J. Chevalier, F. Lepine, J. M. Pagès. Enterobacter gergoviae and the prevalence of efflux in parabens resistance, Journal of Antimicrobial Chemotherapy. 2006, 57(4), 757–760.
33. Halla N, Fernandes IP, Heleno SA, Costa P, Boucherit-Otmani Z, Boucherit K, Rodrigues AE, Ferreira ICFR, Barreiro MF. Cosmetics Preservation: A Review on Present Strategies. Molecules. 2018, 23(7), 1571.
34. Nikonorow E, Baraniak A, Gniadkowski M. Oporność bakterii z rodziny Enterobacteriaceae na antybiotyki β-laktamowe wynikająca z wytwarzania β-laktamaz, Post. Mikrobiol. 2013, 52 (3), 261–271.
35. https://ec.europa.eu/consumers/consumers_safety/safety_products/rapex/ [dostęp na dzień 27.09.2023 r.]
36. Yoon S, Kondakala S. Microbiological Survey of 47 Permanent Makeup Inks Available in the United States. Microorganisms. 2022, 8 (4), 1-9.
37. https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/warning-letters [dostęp na dzień 27.09.2023r.]








